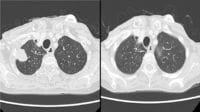
中国製「がん治療薬」の無視できない有望性 米国の承認まであと一歩という新薬も
FDAの承認を得るには、フェーズ3の治験を行う必要があり、そこでは数千人の患者を対象にプラセボとの比較試験で安全性と有効性が確認される。
バーンスタイン・リサーチのアジア太平洋地域ヘルスケア担当アナリスト、ローラ・ネルソン・カーニーによれば、業界の平均を基準にするとフェーズ3の治験が成功する可能性は60~70%だ。
他国開発品より安価になる可能性
チャイメドの最高経営責任者(CEO)のクリスチャン・ホッグは、順調にいけば最短で2019年後半にも承認されるとの見方を示した。「一夜にして成功するには20年の歳月を要する。われわれは今、まさにその地点にいる」
チャイメドのほかにも、BeiGeneは血液のがんで最も多いリンパ腫の治療薬と、腫瘍を根絶するための免疫薬の国際的な治験がすでにフェーズ3に入っている。同社はまた、セルジーンやメルクと共同でがん治療薬の開発も行っている。
アナリストのカーニーは、今後5年間にがん治療薬の世界最大の市場である米国でフェーズ3の治験を実施する中国企業の医薬品は20~30に達すると予測している。また、中国における現在の価格づけの傾向を考えれば、治験をクリアした医薬品は他国のものよりも安価になると考えられるという。
一方、製薬大手は中国における偽造薬の蔓延や手続きの煩雑さの問題に対処するため、中国内に研究機関を設立している。ジョンソン・エンド・ジョンソン、ノバルティス、サノフィなどは中国の患者に向けた医薬品の開発拠点として上海に研究センターを設けた。これらの企業の幹部らは、中国政府が医薬品の特許保護を強化していると指摘する。
当局の承認審査のスピードも速くなっている。製薬会社はこれまで治験を始める認可を得るだけでも最長で2年待たなければならなかった。米国では30日ほどだ。