発がん性リスクに40年間沈黙し続けた世界のGSK 潰瘍治療薬ザンタックは最も売れた処方薬だった
社内実験の不都合な真実は当局に提出されず
FDAは警告を発したが、バリシュアの検査手法も疑問視し、独自のプロトコルで自ら検査を行うと表明。それから1カ月以内に少なくとも二十数カ国で店頭から撤去され流通が停止した。GSKは既に米国でザンタックを販売する権利を手放していたが、自ら供給停止に動いた。17年に独ベーリンガーインゲルハイムから米国での販売権を取得した仏サノフィと、ザンタックを1998-2006年に販売していたファイザーも同様の措置を取った。
GSKの上級幹部が同僚らに対し、タナー氏のリポートは欧州連合(EU)や米国の当局に提出されたのかと19年11月に尋ねたところ、答えはノーだった。どの新薬承認申請にも同リポートを付けていなかった。そしてGSKはようやく、1982年からしまい込んでいた同リポートを提出した。
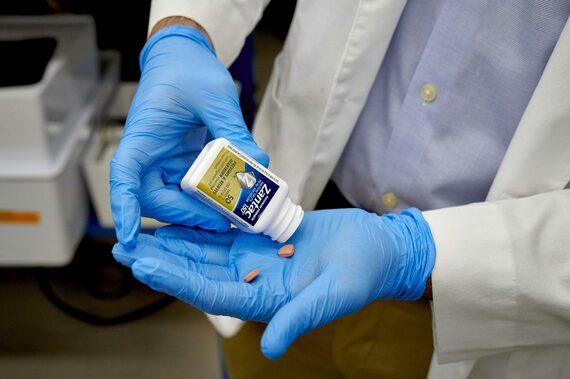

20年4月、FDAは異例の思い切った判断を下した。ラニチジンを製造する企業に対し、形態や用量にかかわらず生産・販売を停止させる措置を取った。ラニチジンは終わりとなった。FDAは「ラニチジン内のNDMAのレベルは通常の保管状態でも上昇する」とし、「流通時や消費者が取り扱う過程でさらされ得る温度を含め、製品が高めの温度で保管されていたサンプルでNDMAの大幅な増加が確認された」と説明した。
FDAの検出した内容の詳細の一部は21年10月まで共有されなかった。共有したのも公表された論文の中でなく、月例講義シリーズ「FDAグラウンド・ラウンズ」の中でだった。FDAによると、最初の検査でクールミントバージョンの錠剤1錠にNDMAが357ナノグラム含まれていた。これはFDAが定める上限の約4倍。4カ月後の検査では931ナノグラムが検出されたという。































