iPS細胞を使った再生医療、今後どうなるのか 初めて臨床研究を行った高橋政代博士に聞く

再生医療新法で、汎用製品が治験入り間近に
――2014年11月に「再生医療等安全性確保法」と「医薬品医療機器等法(改正薬事法)」が施行されました。これらの新しい法律についてどう思いますか。
再生医療は今は"産みの苦しみ"のときで、網膜色素上皮シートによる加齢黄斑変性の治療でも1例目、2例目と苦労しています。ですが、新しい法律の下では、順調に治験を行えば、従来は治験から承認まで10年間くらいかかっていたところが4~5年で仮承認を受けることができます。それは患者さんにとってもすごくいいことですし、企業が安心してちゃんと参入してくれるというのはすごく大きいことですね。
医薬品医療機器等法では、効果は初期には完全に証明できなくても、安全性をきちんと確認したら承認してその後に効果を検証しよう、ということになりました。これが後押しする形で、海外の企業も世界中で行っている治験を途中でやめてでも日本へ、というふうになっています。
再生医療は白内障手術の発展と同じように発展していくだろうなと思っています。最初の10年くらいは、そろそろとゆっくり進んでいくのですが、あるときに大きく前進して非常によい治療になる。白内障手術は、昔は危険性も非常に高くて、乱視も生じて、視力もそんなに上がらないような手術だったのです。ところが、1990年代に臨床の医師がどんどん工夫をして、企業もいろいろと改良して、10年の間に非常に効果が高まり、今ではほとんど完成されて安全な手術になっています。
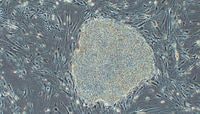
――iPS細胞で作った網膜色素上皮細胞の臨床研究(解説4ページ)では、2011年にジャパン・ティッシュ・エンジニアリング(J-TEC)と提携しましたが、今後の汎用製品の治験についてはヘリオス(旧日本網膜研究所)が準備を進めています。
J-TECは大変な苦労をして、日本で初めての再生医療製品である自家培養表皮の承認を2007年に取得しました。そのノウハウを教えてもらったおかげで、臨床研究までの時間が著しく短くなりました。試薬の製造工程までチェックしてヒトに使えるかどうかを調査することなどを教えてもらって、実際にやってくださいましたし、ものすごくありがたかったです。