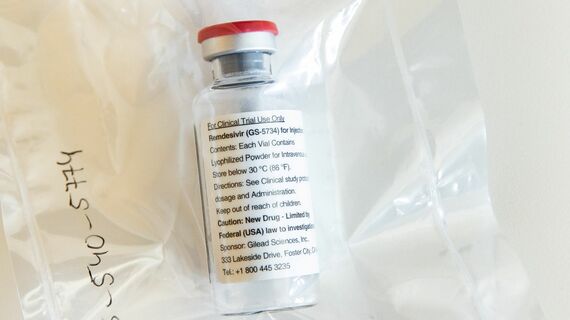
国内初となる新型コロナウイルス感染症の治療薬が、重症患者を対象として5月にも承認される見通しとなった。安倍晋三首相は4月27日、新型コロナ治療薬の候補である「レムデシビル」について、「間もなく薬事承認が可能となる見込み」と発言。政府は、海外での承認などを条件に審査手続きを簡略化する「特例承認」により、保険適用で使えるようにする方針だ。
これまで安倍首相は会見のたびに、国内メーカーである富士フイルム富山化学の抗インフルエンザ治療薬「アビガン」を新型コロナ治療薬の有力候補に挙げてきたが、より早期承認が実現できそうなレムデシビルが大きくクローズアップされるようになった。
緊急事態宣言の期限が5月6日に迫る中、国民の不安を解消する上でも治療薬の存在は大きい。ただし、まだレムデシビルはヒトに対する有効性を検証する治験のデータが公表されているわけではなく、海外でも未承認だ。製品は輸入に頼ると見られ、どれだけの量を日本が確保できるかも未定で、期待の先走りには注意が必要だ。
治験データの公表はこれから
レムデシビルはエボラ出血熱の治療薬として、アメリカの製薬会社「ギリアド・サイエンシズ」が開発してきた。ウイルスに対する効果を試験管内で行った実験で、新型コロナウイルスの増殖を抑える働きが高いことが確認され、候補薬に挙がるようになった。しかも、ウイルス増殖への抑制効果は、アビガンを含むさまざまな抗ウイルス薬のなかで最も高いことが実験から判明している。
これらの実験結果をもとに、日本では3月に国立国際医療研究センター(東京)がレムデシビルの臨床試験を開始すると発表。同センターで国際感染症センター長を務める大曲貴夫医師は、「標準薬がなく時間も限られる中で治験をするには、まずレムデシビルから医師主導治験をするのが筋だろう」と述べた。「日本発」のアビガンに期待が集まるのは仕方ない部分はあるが、研究現場ではレムデシビルのほうが優先して治験が行われているのが実情である。
































無料会員登録はこちら
ログインはこちら