インド拠点が禁輸、第一三共M&Aの蹉跌 約5000億円で買収したインド子会社で問題頻発
FDAが1月11日に公表したトアンサ工場の査察報告書には八つの所見が並ぶ。そのうち、4ページと記述が最も多い所見1を要約すると、医薬原料や中間物の分析で、品質管理上疑わしいものを、許容できる結果が得られるまで繰り返しテストしたと指摘。欠陥の見られる結果は報告されていないという。
残る所見のうち、コンピュータシステム上の統制不備、施設の保守不備は、「12年12月と同じ所見」「12年12月にも議論した」と、あえてアルファベットの大文字で記し、前回から改善が見られないことを強調している。禁輸措置を受けた当初の2工場でも指摘された問題を解消しておらず、会社全体に学習効果がないという印象だ。
成長戦略の修正が必至

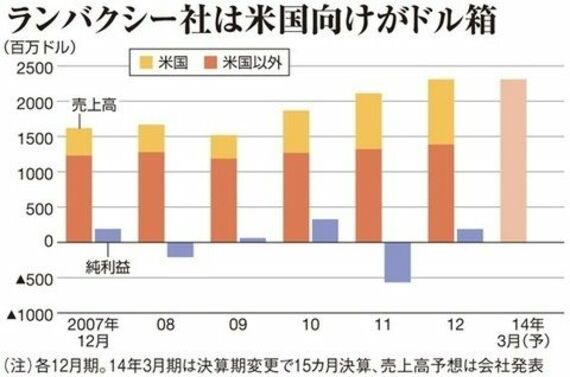
同社を08年に子会社化した第一三共は、いったい何をしていたのか。買収時、新薬の潜在的なライバルである後発薬を取り込むことについて、新しい試みとして市場は総じて好意的だった。会社の特質の違いから当時の庄田隆社長(現会長)は「あえてハンドリングしない」としていた。
株式の公開買い付けが完了した08年9月、FDAの処分にリーマンショックが重なり、ランバクシー社の株価が急落。第一三共は買収年度に3540億円もののれん代を償却し、赤字に沈んだ。その後、創業一族のCEOを代え、品質管理体制も点検した。にもかかわらず、またも同じ問題で禁輸を食らった。
今回の事態を受けて、1月31日の第3四半期決算説明会で、坂井学専務は「FDAの措置は、さらに踏み込んだ取り組みをせよということと、とらえている。どこまでやれば十分な対応策になるか検討している」と述べた。
将来を見越し、新興国に販路を持つランバクシー社を抱えることに合理性はあるが、今回の問題で成長戦略の修正が必至。まずは同社の実態把握が急務だ。そして、経営責任の明確化も避けて通れない。
(週刊東洋経済2014年2月15日〈2月10日発売〉号 核心リポート02に一部加筆)
記事をマイページに保存
できます。
無料会員登録はこちら
ログインはこちら
印刷ページの表示はログインが必要です。
無料会員登録はこちら
ログインはこちら






























無料会員登録はこちら
ログインはこちら