テルモ、心臓治療で再生医療の産業化へ挑む 改正薬事法の下で2製品がスピード承認
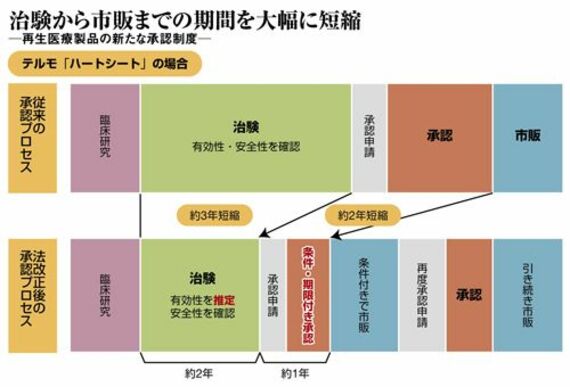
状況を打開すべく、国は再生医療の法改正を実施。特に画期的なのは、2014年11月施行の医薬品医療機器等法(改正薬事法)で、再生医療の「条件・期限付き承認」を認めたことだ。臨床試験(治験)の症例数が少なくても、有効性が推定されれば市販できる。仮免許のようなものだ。
旧薬事法は大勢の患者による比較試験で有効性を確認することを求めていた。だが、テルモのハートシートの治験は、わずか7例。「(法改正がなければ)さらに50~100例の治験を行うために3~5年かかる可能性もあった」(テルモの鮫島正・研究開発本部研究主幹)。今後は販売しながら60例で治療の有効性を検証し、5年以内に再度、正式な承認に向けた申請を行うことが条件である。
審査期間も短縮された。J|TECの2製品は、旧法の下で申請から承認まで約3年間を要した。だが、法改正により医薬品でも医療機器でもない「再生医療等製品」というカテゴリーが新設されたことで、ハートシートと、同時に承認を取得し骨髄移植時の合併症を対象としたJCRファーマの「テムセルHS注」は、いずれも約1年のスピード承認となった。
産業化ができるか、値付けが焦点に
患者にとり、新しい治療法が早く届くのは朗報だ。企業にとっても開発資金の回収が早まり、開発のインセンティブが増す。現在10~20品目が治験中で、欧米の大手製薬企業も、制度が整った日本で開発する準備を進めている。
ただ、再生医療の離陸には、課題も多い。条件・期限付き承認のリスクとして、多くの患者に使ってみて初めて、有効性が確認できないとわかることもありうる。
価格決定という大きなテーマも残る。厚生労働相の諮問機関である中央社会保険医療協議会が、早ければ年内にも2製品の価格を決め、その後に保険収載、発売となる。法改正後の最初の製品だけに、その価格は今後の目安となる。再生医療が普及するためには、企業が利益を出せて、かつ、国民の医療費負担を抑制できなければならない。

































無料会員登録はこちら
ログインはこちら