東大病院の不正は患者情報流出だけではない ノバルティス白血病薬の臨床研究で患者に虚偽の説明

東京大学医学部附属病院が中心となり22の医療機関が実施した慢性骨髄性白血病(CML)治療薬を用いた医師主導臨床研究「SIGN研究」で、254人分の患者情報が大手製薬ノバルティスファーマの手にわたっていたことが明らかになった。不正に流出した患者情報の中には、性別や生年月、イニシャル、副作用情報などのほかに、個人が特定できる患者IDも203人分が含まれていた。
これらの事実は3月14日に東大病院が記者会見で明らかにした。医療機関から製薬メーカーに患者情報が流れること自体があってはならないことだが、規模の大きさや不正が1年近くにわたって続いたことから見ても、前代未聞の不祥事といえる。
実質は製薬メーカー主導
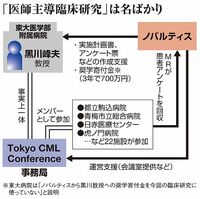
問題となった医師主導臨床研究については、ノバルティスの記者会見および独自取材を元にして、記者はこれまで複数回にわたって「実質は製薬メーカー主導」と指摘している(ノバルティス、白血病薬不正の隠せぬ証拠、厚生労働省に重要事実「隠ぺい」の疑惑など)。
具体的には、臨床研究実施に際しての患者へのアンケート用紙や説明文書作成などにノバルティス社員が関与した形跡があったほか、アンケート結果を同社社員が臨床研究に参加した医療機関から入手して東大病院に運んでいたことなどが、同社の発表や取材を通じて明らかになっていた。
今般の東大病院の調査では、そうした実態が改めて確認されるとともに、患者IDの流出や医師が作成するルールになっている学会発表資料の一部がノバルティス社内で作成されていた事実も新たに判明した。
医師主導臨床研究は、その名前のとおり、そもそも製薬メーカーから独立したものでなければならない。もし製薬メーカーから一定の支援を受けた場合には、その内容を明示することが、利益相反に関するガイドラインなどで決められている。東大病院は「学内や学会発表における現行の利益相反規定に基づいて申告されており、明白なルール違反はなかった」と今回の調査報告書で述べている。
その一方で、「透明性の観点からノバルティス社から(今回の臨床研究の推進の役割を担った研究会組織である)Tokyo CML Conference(TCC)への役務提供があったことなどについて、この研究自体に関する利益相反として(学内の)倫理審査申請時や学会発表時に開示しておくべきだった」とも報告書の中で説明している。
東大病院の門脇孝病院長は「患者IDが流出したことは、一連の事例の中でも最も深刻な問題だ」、「製薬メーカーから役務の提供を受けたことはそれ自体が医師主導臨床研究のルールからの重大な逸脱だった」と述べている。
だが、問題はそれだけではない。医療倫理の面でもきわめて深刻な事態が起きている。
































無料会員登録はこちら
ログインはこちら