漢方薬のトレーサビリティ確立に挑む、ツムラが対峙する中国産生薬の安全
厚労省の「指導」なし 後手に回る生産履歴管理
実は、漢方薬の薬価収載は87年でストップしている。厚生省(当時)は70年代半ばから約10年、集中的に漢方薬の承認、販売許可を行った。通常、医薬品の承認申請には、最大10年にも及ぶ治験(ヒトに投与して安全性・有効性を確認する試験)が必要。だが、長い歴史を持つ漢方薬は伝統的にその効果が認知されている、として特別に治験なしでリストに加えられた。
この特殊期間の終了後、漢方薬も承認に際し莫大な費用と時間のかかる治験が必須になった。新しい作用の薬であれば、発売後、治験費用を大幅に上回る収入が期待できる。しかし漢方薬の薬価は下がる一方であることから投資回収が期待できず、新規参入する会社が現れないのだ。
ツムラは76年からの11年間に計129品目の薬を申請し、販売許可を受けた。ちなみに、ツムラに次ぐ業界2位のクラシエは約半数の57品目と数では到底太刀打ちできず、シェアはたったの1割。トップメーカーが市場のうまみを独占する構図は、揺るぎそうもない。
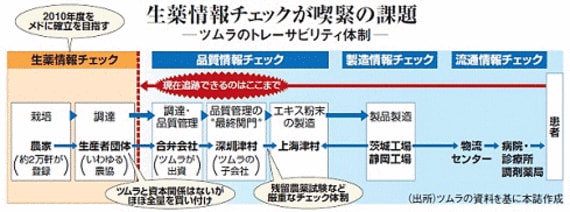
しかし、このトップメーカーが今、解決を迫られる緊急課題がある。調達の8割以上を依存する、中国産原料のトレーサビリティ(生産履歴管理)体制の確立である。「毒ギョーザ事件」をきっかけに食品業界がその対応を迫られた一方で、漢方薬には厳しい目は向けられてこなかった。医薬品の管轄である厚生労働省からも「指導を受けたことがない」(ツムラ)という。
だが本来、治療に用いられる漢方薬は、食品以上にその安全性が問われてしかるべきだ。残留農薬などの問題が発覚してからでは遅い。仮に問題が発生した場合、現状では発生源を特定することもできないのだ。
下図は漢方薬の原料調達から処方されるまでの過程だ。中国各地の農家で作られた生薬は、生産者団体(日本でいう農協)を通じ、ツムラが出資する四つの合弁会社に運ばれる。農家が禁止農薬を使った場合、この合弁会社の品質管理システムで排除され、さらに最終関門である深せんの子会社で再度厳重なチェックが加わる。