サンバイオ、新薬承認で異例の遅れが生じた背景 2019年のサンバイオショックから新たな正念場
2001年にアメリカで創業して以来、脳の疾患に関する細胞治療薬「SB623」を開発してきた日本の創薬ベンチャーのサンバイオ。今、2度目ともいうべき正念場を迎えている。
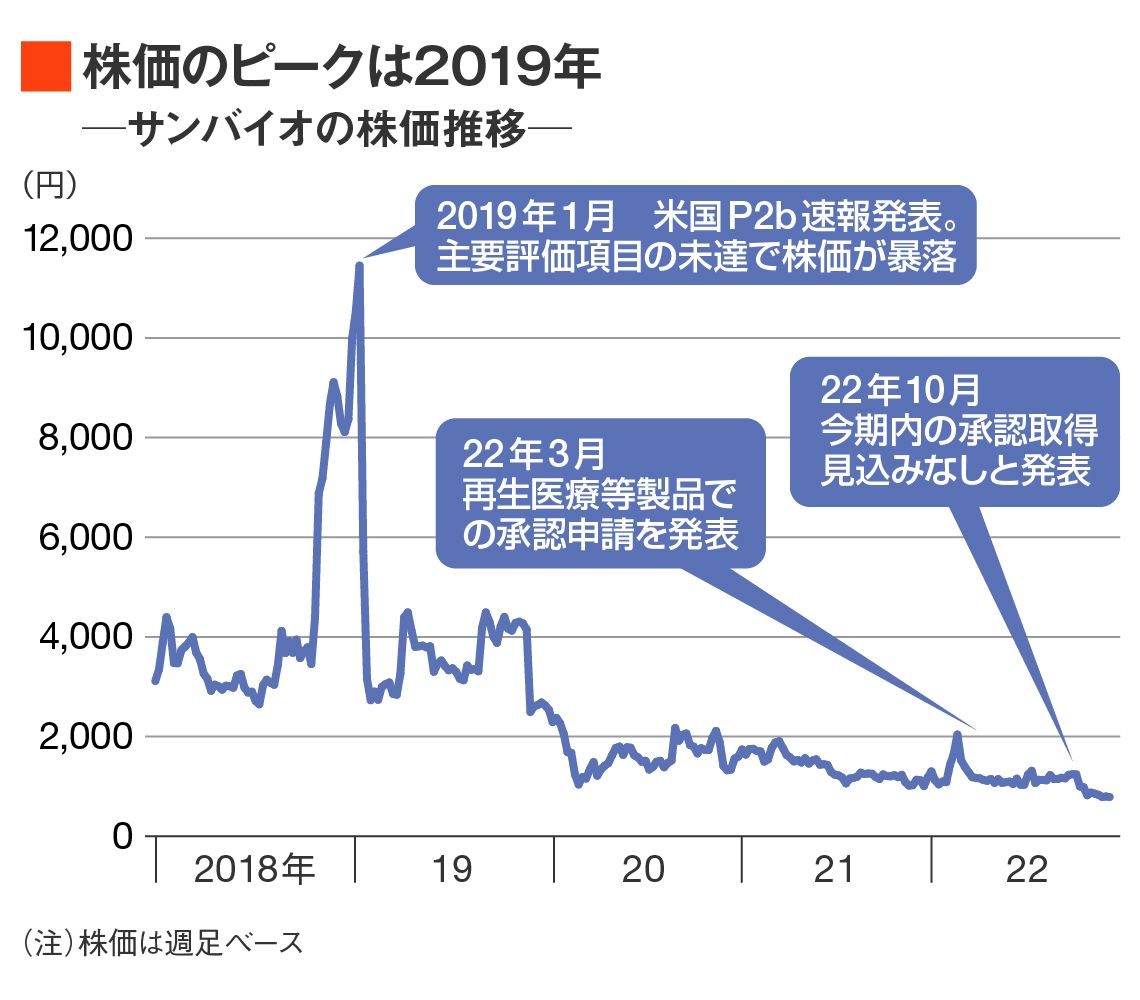
1度目は、2019年1月だった。成功が有望視されていた慢性期脳梗塞の薬を患者に投与する臨床試験(治験)において、アメリカでの後期2相(P2b)で有効性が示せなかったことを発表。期待先行からザラ場で一時は1万2000円を突破した株価は瞬く間に3000円台まで暴落し、市場では「サンバイオショック」と呼ばれた。
その後も慢性期脳梗塞の開発を続けているが、目下、山場を迎えているのは世界で毎年2700万人が交通事故転倒などが原因で患者となる慢性期の外傷性脳損傷(TBI)の再生細胞薬だ。
2022年3月に待望の「国内申請」にこぎ着けた
2018年11月、サンバイオは日米で実施したTBIの国際共同臨床試験の2相(P2)で安全性・有効性を示す結果を出している。
TBIで入院して生存する患者は50%未満、一命を取り留めた患者も長年運動障害を抱える。サンバイオの細胞治療薬は、不可能といわれた脳神経細胞の再生を促すことで運動機能などの改善を促すもの。承認されれば、慢性期TBI向けでは世界初の細胞治療薬となる。
日本には有効な治療薬のない希少疾患・難病向けの細胞薬などでは、最終の3相試験を行う前に条件・期限付きの早期承認を認める医薬品の承認制度がある。サンバイオはP2データを基に、この制度を利用し、まずは国内での申請・承認を目指してきた。
そして2022年3月、待望の国内申請にこぎ着けたが試練は続いている。SB623のように、画期的な新薬に対して審査を優遇する「先駆け指定」を受けた薬について審査期間のメドは6カ月。サンバイオの場合、2022年末を迎えてもまだ承認されていないのだ。
なぜ審査が長引いているのか、果たして承認されるのか。


































無料会員登録はこちら
ログインはこちら