創薬を加速させる米国発「デジタル企業」の底力 「治験のDX」で薬を少しでも早く患者の元へ

新薬ができるまでの長く険しい道のり
――メディデータとはどのような会社ですか。
上田 1999年に米国で創業されたライフサイエンス企業です。治験の情報を管理するプラットフォームを提供しており、世界140カ国以上で利用されています。2022年に米食品医薬品局(FDA)が承認した新薬のうち73%※1は、私たちのプラットフォームを使って治験が行われました。

医師・医学博士
ジャパンセールス ヴァイス・プレジデント
血液内科医として10年の臨床経験ののち、製薬企業で臨床開発を担当。その後、事業部長として医薬品の営業・マーケティングの責任者を務める。デジタルのテクノロジーで医薬品開発をさらに推進する思いを持って、2022年よりメディデータに参画
日本には05年に進出。EDCと呼ばれる電子的に治験情報を収集するシステムの国内シェアは41.9%※2に達しており、日本でも広く支持を得ています。
※1 同社調べ
※2 富士経済 『2022年 医療AI・医療ビッグデータ関連市場の現状と将来展望』 EDCシステム 2021年実績 数量ベース
――そもそも治験とはどのようなものでしょうか。
上田 製薬会社で開発された新しい薬はそのまますぐに市場に出せるわけではなく、3段階に分けて実際に人に投与する臨床試験が行われます。
第1相は健康な成人に投与して安全性を確認する試験で、比較的小規模。ケース・バイ・ケースですが、期間は半年〜1年です。副作用が問題ないレベルだとわかれば、患者さんに投与して有効性を検証する第2相の試験に入ります。期間は1年半〜2年。
また、効くことがわかっても、既存の薬と比べて効果が上回っていなければ市場に出す意味はありません。そこで第3相では既存の薬との比較試験が行われます。期間や規模は疾患によりますが、生活習慣病の場合は3~5年かけて数千人規模の被験者に試験することもあります。
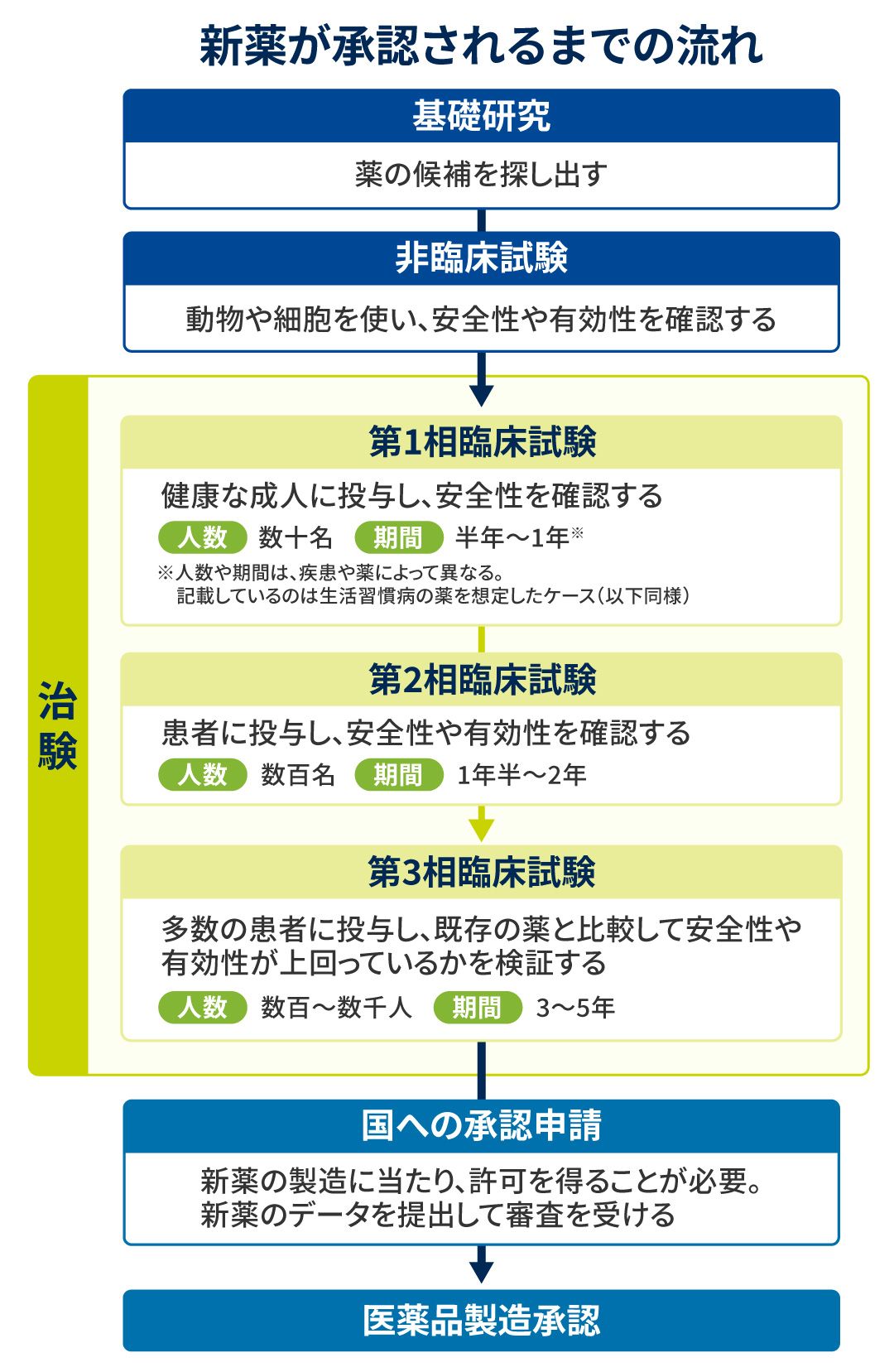
創薬のプロセスは、10年以上かかる長い旅。最終的に当局に承認され、創薬が成功する確率は約3万分の1ともいわれる厳しい世界です。
――メディデータが提供しているソリューションはどのようなものですか。
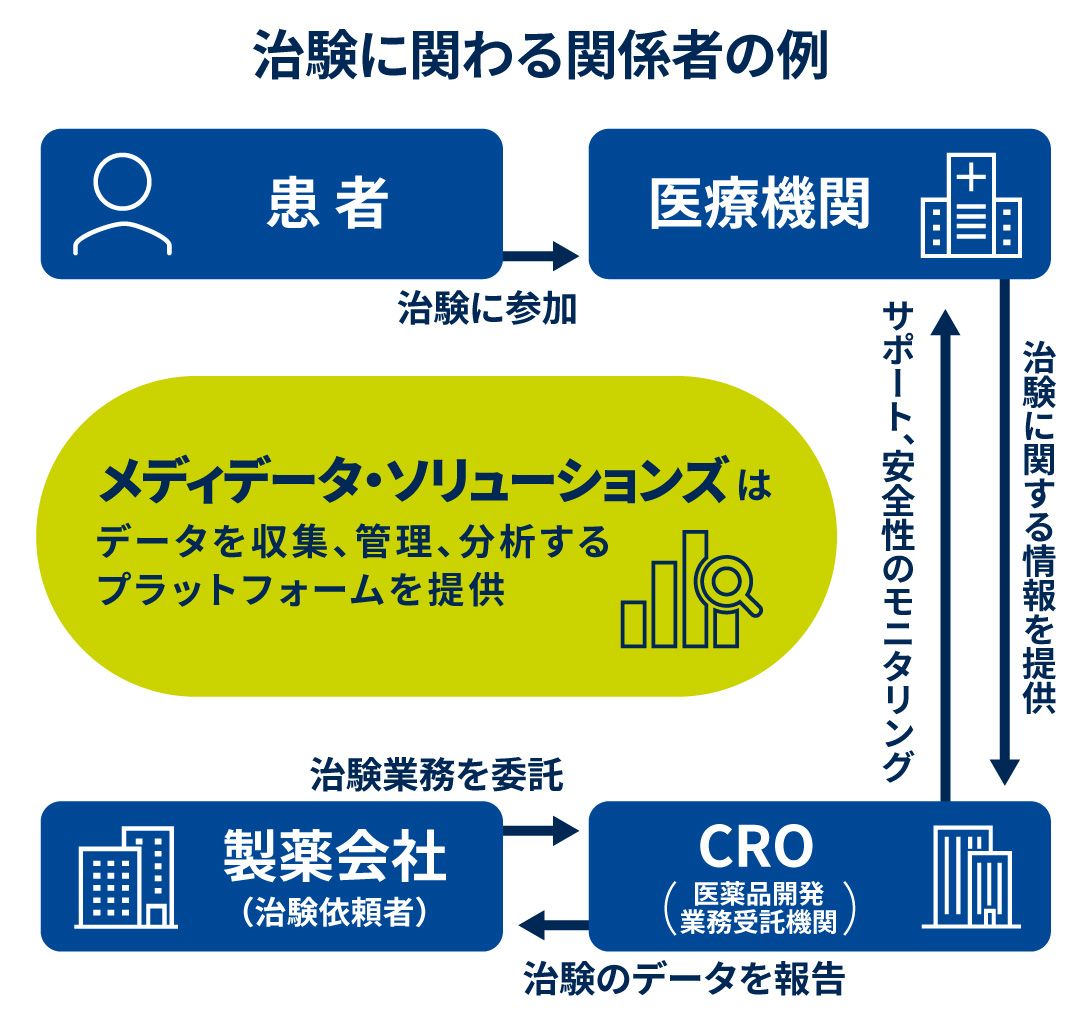
西 治験には多くのプレーヤーが関わります。まず薬を開発する製薬会社がスポンサーになります。
実際に治験業務を担うのは、外部の受託機関であるCRO(医薬品開発業務受託機関)です。治験そのものは病院やクリニックで行われ、それに参加する患者さんも必要です。

プロフェッショナルサービス ヴァイス・プレジデント
日系製薬会社に入社し、臨床統計業務、データマネジメント業務、CRO管理業務、抗うつ薬などの開発業務に携わる。2009年に外資系製薬会社に転職。データマネジメント業務のアウトソーシング、データマネジメント組織の立ち上げなどを主導。2015年3月よりメディデータに参画
投与した結果に関するデータは医療機関からCROや製薬会社に送られて、分析後、臨床試験を先に進めるかどうかの意思決定に使われます。また、承認を申請するために規制当局にも提出され、さまざまなプレーヤー間でデータのやり取りが発生します。
20年ほど前は治験の情報を紙でやり取りしていましたが、メディデータはそれらをデジタル化し、一貫性のある形で収集、管理、分析できるプラットフォームを提供しています。20年以上にわたり蓄積された情報を提供することで、治験の効率化と患者さんの安全性の確保を後押ししています。
治験を効率化して新薬開発をスピードアップ
――治験の情報管理をデジタル化することによって、患者にはどのようなメリットがあるのでしょうか。
上田 情報の収集や分析のスピードが上がって、治験にかかる期間を短縮できます。治験は多くの人が関わるので、情報が散らばりやすく伝達や整理にどうしても多くの時間や手間がかかりました。その点、私たちの提供するデジタルのプラットフォームを使えば、よりスピーディーに進めることができます。
1つの試験の準備からデータ整理まで1~2年かかるとすると、試験単体で数週間から数カ月は短くなります。さらに見逃せないのが異なる相の試験と試験の間の期間です。試験結果を見て製薬会社の経営層が治験を次のプロセスに進めるかどうかの意思決定を下すのですが、整理された見やすいデータをいち早く見られるので意思決定も以前より速くできるでしょう。
実は私は血液内科医で、臨床経験が10年あります。患者さんと接する立場にいたときは、治験に時間がかかることがもどかしくてなりませんでした。
少しでも早く薬を世に出せれば、それだけ救われる患者さんも増えます。その後、製薬会社を経て転職したのも、治験を効率化して患者さんに早く薬を届けたかったからです。その意味で、メディデータの貢献は大きいと思います。
西 現在、治験のデータは医療機関のみならず患者さんがクラウド上のシステムに直接入力できるようになりました。患者さんのスマートフォンから体調や症状などの登録ができます。患者さんの状況がリアルタイムで把握できれば、医師が副作用などのリスクをコントロールしやすくなるのです。

また、臨床試験の質も上がります。紙や電子ファイルのやり取りではヒューマンエラーが起こりやすいですし、時間が経つと記憶間違いなどでデータが歪むおそれもあります。データをリアルタイムで取って収集を自動化すれば、データ品質が上がって治験の信頼性が高まり、よい薬を患者さんに早く届けることができるようになります。
あるコロナワクチンの治験でも、実はメディデータのプラットフォームが活躍しています。コロナ禍で被験者は医療機関に行くことが難しい状況でしたが、メディデータのプラットフォームなら患者さんが自宅から治験に参加することができ、また世界各国で行った治験データも簡単に集約できます。治験は1年弱で終わって承認が下りたのですが、従来のやり方ならもっと時間がかかっていたでしょう。
膨大な治験データを基にAI活用を推進
――メディデータの強みと今後の展望を教えてください。
西 システムの柔軟性やセキュリティーなどテクニカルな優位性はいろいろありますが、より強調したいのは顧客の声を真摯に聞く姿勢です。私の前職は某製薬会社。治験を担当して治験情報システムを選ぶ立場にいたのですが、メディデータはグローバルのトップが日本までやってきて、こちらのニーズに合わせてシステムの継続的な改善と運用を行ってくれました。
よいシステムだからそのまま使ってください、というのではなく、患者さんや医療機関、製薬会社、CROからの声を積極的に聞いてフィードバックを生かす姿勢は今も変わりません。
上田 私たちが支援した臨床試験数はすでに3万件を超え、試験参加者数も900万人を突破、膨大な治験データが蓄積されています。今後はこのビッグデータを使ってAIを活用することも始めています。例えば過去の臨床情報のビッグデータを機械学習し、副作用が発生しやすい状況を割り出し、あらかじめ対症療法を準備しておくなどの利用法が考えられます。
また、過去の豊富なデータがあれば治験のシミュレーションも可能になると考え、研究を続けています。精度の高いシミュレーションができれば、それを基に治験をデザインし、もっと少ない人数や期間で行い、患者さんや製薬会社の負担を減らせるでしょう。メディデータだからできることを今後も追求していきたいですね。






